Исследователи создали синтетический полимер (PLP), который блокирует взаимодействие белков KEAP1 и Nrf2, играющих ключевую роль в развитии сердечной недостаточности после инфаркта. В норме Nrf2 защищает клетки от воспаления, но после инфаркта KEAP1 связывается с ним, запуская его разрушение и замедляя заживление. PLP имитирует белок Nrf2 и прочно связывается с KEAP1, за счет чего не дает ему атаковать настоящий белок. Это сохраняет активность Nrf2, стимулируя восстановление сердечной ткани и предотвращая гибель клеток. В эксперименте на крысах однократное введение этого препарата улучшило восстановление сердечной ткани и работу сердца в течение пяти недель после инфаркта. Результаты опубликованы в журнале Advanced Materials.
Инфаркт случается, когда к участку сердца перестает поступать кровь. Обычно это происходит из-за закупорки сосудов сердца тромбом или атеросклеротической бляшкой. Без кислорода клетки сердечной мышцы начинают умирать. Факторы риска инфаркта включают возраст, курение, высокое кровяное давление, повышенный холестерин, диабет и ожирение. После инфаркта люди обычно проходят курс реабилитации, принимают лекарства для снижения нагрузки на сердце и предотвращения повторных приступов. В некоторых случаях требуется операция для восстановления кровотока.
Исследователи разработали новый препарат, который вводят в вену сразу после инфаркта миокарда. Он помогает сердцу восстанавливаться и предотвращает развитие сердечной недостаточности.
В основе терапии лежит специальный полимер, который имитирует белок Nrf2. В норме белок KEAP1 связывается с Nrf2 и приводит к его разрушению, что мешает клеткам сопротивляться воспалению и стрессу. Новый полимер после введения находит KEAP1 и блокирует его, не давая разрушать настоящий Nrf2. Благодаря этому клетки сердца лучше защищены от повреждений и могут быстрее восстанавливаться после инфаркта.
Для проверки эффективности метода ученые провели серию экспериментов на крысах. После искусственно вызванного инфаркта часть животных получила однократную внутривенную инъекцию PLP, а другая часть — физиологический раствор (контрольная группа). При этом ученые в ходе наблюдений не знали, какое животное получило препарат, а какое — плацебо.
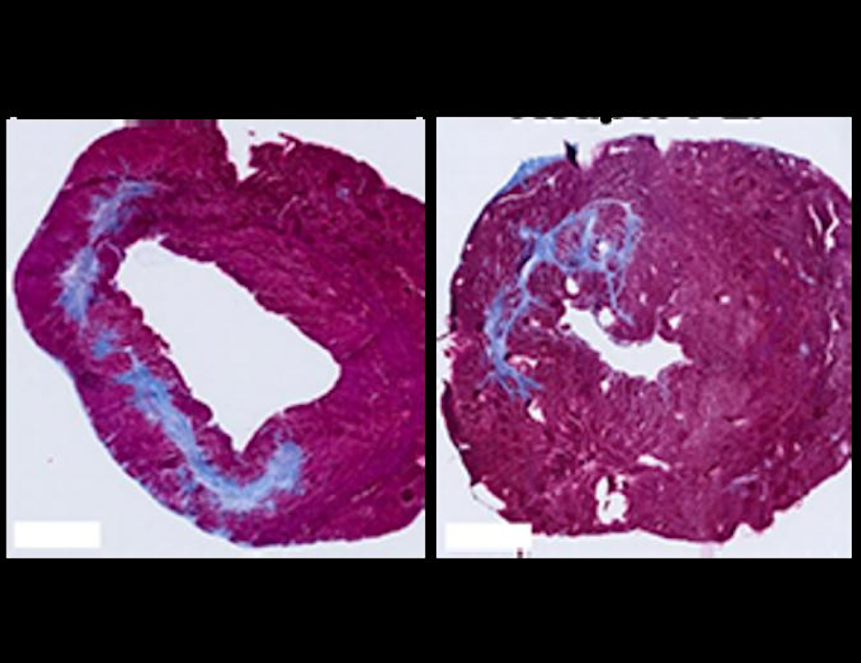
Через пять недель после введения препарата крысам сделали МРТ сердца под наркозом. У животных, получивших PLP, показатели работы сердца были значительно лучше, чем в контрольной группе. В их сердечной мышце было больше признаков заживления и восстановления ткани.
Дополнительные анализы, включающие ПЦР и протеомику, показали, что в сердцах крыс, получавших полимер, активнее работали гены, отвечающие за восстановление тканей и рост новых кровеносных сосудов, такие как Hmox1 и Nqo1. Кроме того, ученые выявили изменения в экспрессии 374 генов, связанных с инфарктом миокарда, включая гены ответа на воспаление (Ccl2, Cxcl1, Il1b, Nupr1) и привлечения клеток иммунной системы — нейтрофилов (Cxcl1, Cxcl2, Tlr4).
Исследователи отмечают, что эта работа — пока только доказательство принципа. Перед переходом к испытаниям на более крупных животных и людях им необходимо оптимизировать состав и дозировку препарата, а также провести дополнительные анализы.
Технология PLP может быть полезна для восстановления не только после инфаркта, но и после других заболеваний, связанных с воспалением и окислительным стрессом.
«Эта терапия обладает огромным потенциалом для лечения нескольких заболеваний, включая все от разрушения желтого пятна до рассеянного склероза и заболеваний почек», — рассказал Натан Джаннески из Северо-Западного университета, США.
Автор: Оксана Гриценко.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





