Биологи выяснили, что улучшить состояние клеток, страдающих от избытка глюкозы, можно, заблокировав транспортер VDAC1 во внешней мембране митохондрий — «энергетических станций» клеток. VDAC1 обеспечивает обмен веществ между митохондриями и цитоплазмой, подобно то открывающимся, то закрывающимся воротам. Количество этих белков в некоторых тканях значительно возрастает при сахарном диабете: это приводит к окислительному стрессу и гибели клеток. Авторы предложили уменьшать число и активность транспортеров с помощью технологии CRISPR/Cas9 и молекул-блокаторов. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Antioxidants.
Уровень в крови глюкозы — основной молекулы, из которой наш организм извлекает энергию, — в норме строго контролируется. Сразу после приема пищи он возрастает, после чего довольно быстро (в течение 3–4 часов) снижается до исходного. Однако при нарушении обмена веществ, например сахарном диабете, концентрация глюкозы постоянно остается высокой, и это состояние называют гипергликемией. Она негативно сказывается на многих органах, увеличивая риск сердечно-сосудистых заболеваний, поражения нервов, разрушения костей и проблем со зрением. Этот эффект связывают с тем, что избыток глюкозы приводит к нарушению окислительно-восстановительных процессов в клетках из-за повреждения митохондрий — «энергетических станций» клетки.
Между митохондриями и всей остальной клеткой происходит постоянный обмен питательными веществами и сигнальными молекулами, который обеспечивают «встроенные» в мембрану митохондрий белки-транспортеры семейства VDAC. При сахарном диабете в некоторых органах и тканях их число увеличивается, и это приводит к тому, что в клетку из митохондрии в избыточном количестве начинают поступать активные формы кислорода — молекулы, в высоких концентрациях повреждающие мембраны и ДНК, — а также вещества, стимулирующие программируемую клеточную гибель. Поэтому ученые предполагают, что, частично заблокировав работу белков VDAC1, удастся бороться с негативными последствиями гипергликемии.

Рисунок 1. Соавторы статьи Михаил Дубинин, Наталья Белослудцева, Анна Ильзоркина, Влада Старинец, Константин Белослудцев (слева направо). Источник: Константин Белослудцев
Ученые из Марийского государственного университета (Йошкар-Ола) с коллегами проверили эту гипотезу. Авторы использовали в экспериментах культуры эндотелиоцитов мышей — клеток, выстилающих стенки сосудов, — а также фибробластов человека — клеток соединительной ткани.
Исследователи протестировали два подхода, позволяющих добиться уменьшения уровня или активности интересующего белка в клетках. В первом случае биологи с помощью технологии геномного редактирования CRISPR/Cas9 «выключили» ген, кодирующий белок VDAC1. В результате в полученных клетках осталось только 10% белка от нормы. Во втором случае клеточные культуры просто обработали молекулой-ингибитором, связывающейся с белковыми каналами VDAC1 и блокирующей их. Затем все клетки помещали на 36 часов в раствор глюкозы для создания условий гипергликемии. В качестве контроля использовались культуры, в которых уровень VDAC1 не изменяли.
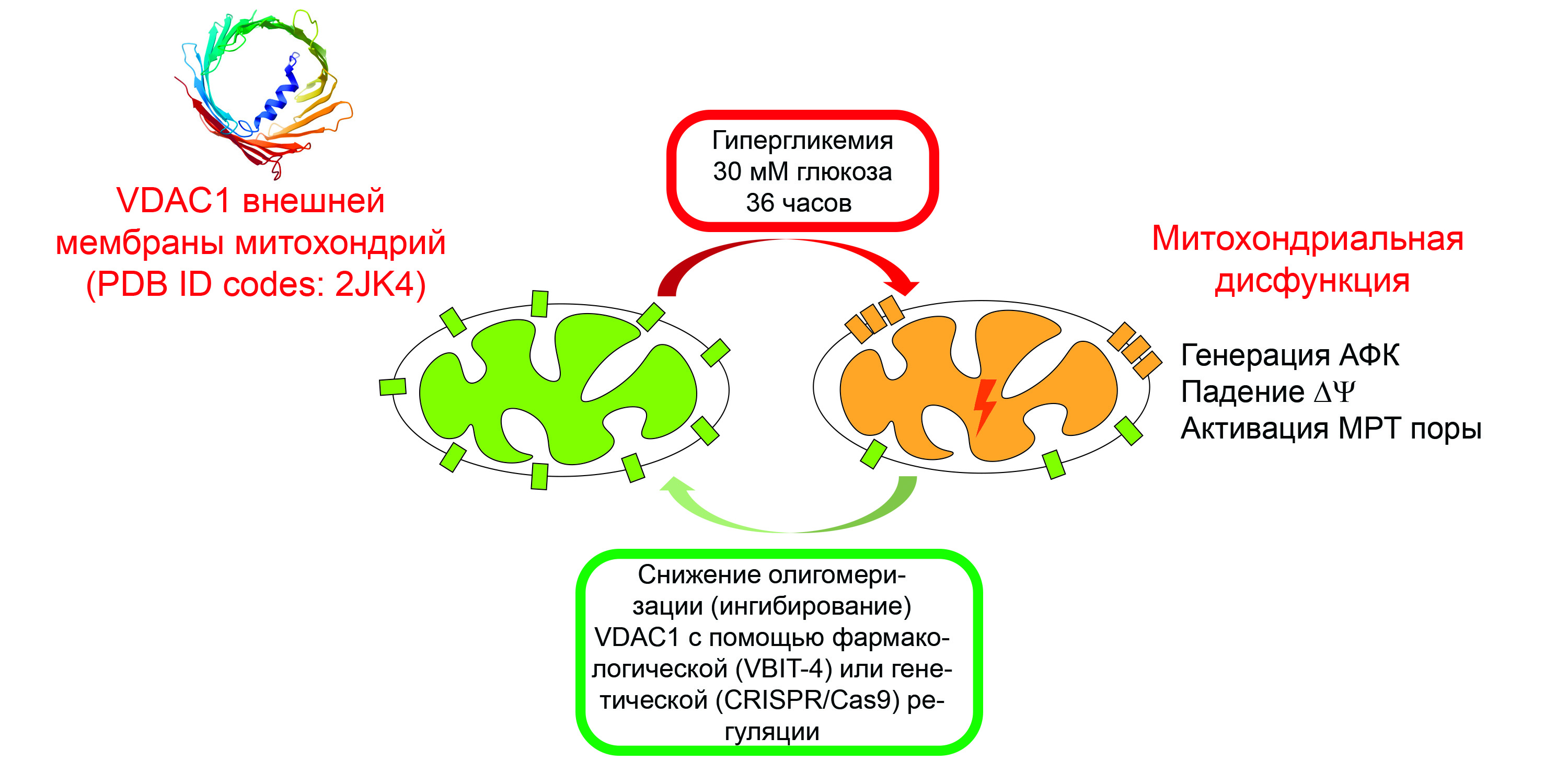
Рисунок 2. Схема нарушения работы митохондрий при гипергликемии и ее коррекции фармакологическим или генетическим подавлением VDAC-каналов. Источник: Константин Белослудцев
Ученые сравнили состояние клеток и работу митохондрий в каждом случае, подкрашивая интересующие структуры и молекулы флуоресцентными («светящимися») красителями. Оказалось, что митохондрии со сниженным количеством каналов VDAC1 производили почти в полтора раза меньше активных форм кислорода по сравнению с контрольной группой, что пропорционально уменьшало негативное влияние на клетки и риск их гибели от окислительного стресса.
Кроме того, исследование показало, что при гипергликемии в клетках снижается активность генов, участвующих в увеличении количества митохондрий. Это может привести к нехватке энергии, необходимой для нормальной работы клеток. В случаях, когда ген VDAC1 был заблокирован с помощью технологии CRISPR/Cas9, этот негативный эффект пропадал.
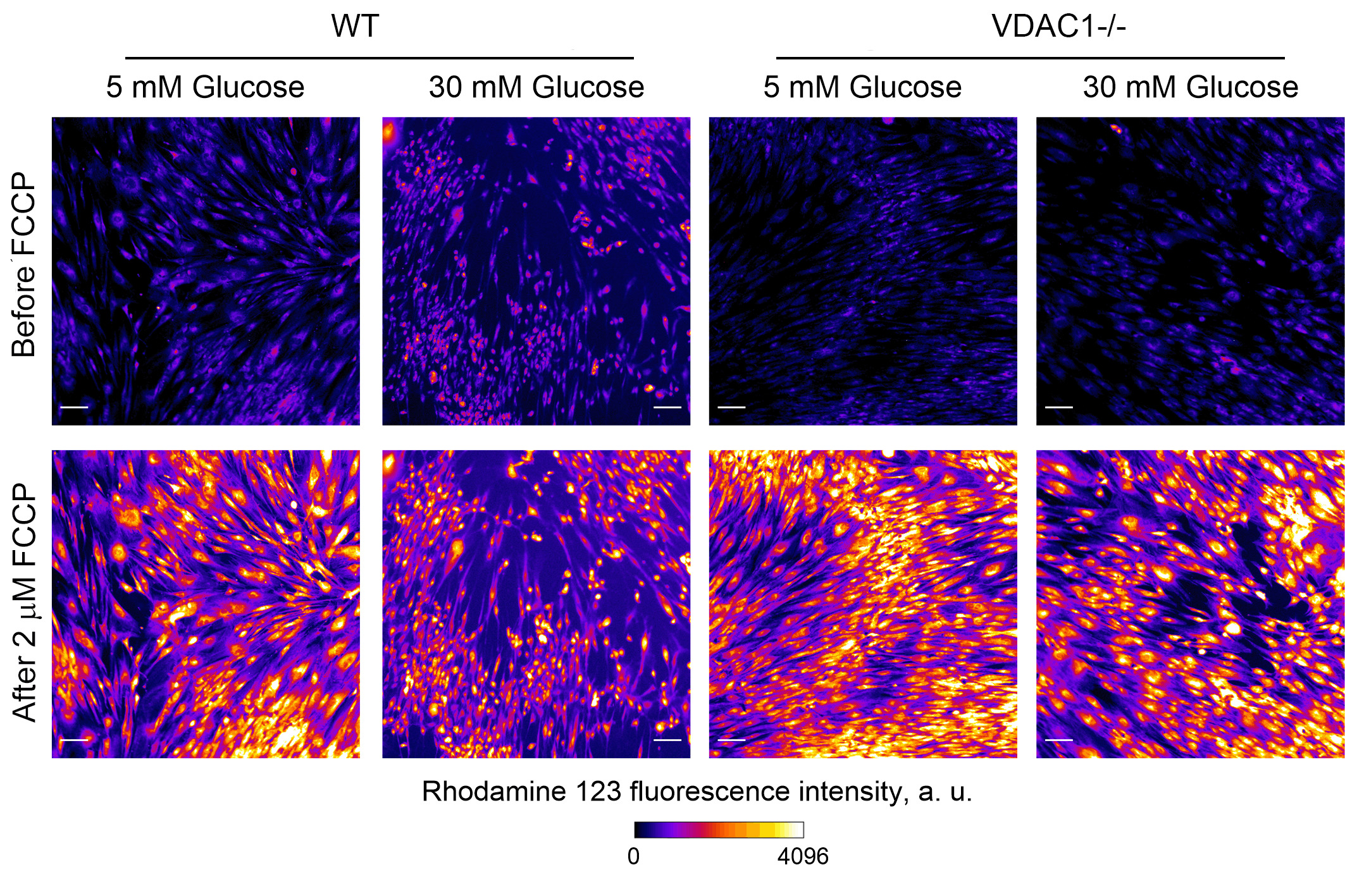
Рисунок 3. Изменение мембранного потенциала митохондрий в фибробластах кожи человека с нормальной (WT) и пониженной (VDAC1-/-) экспрессией VDAC1 в условиях нормо- и гипергликемии до и после добавки молекулы-разобщителя. Источник: Константин Белослудцев
«Исследователи давно бьются над нормализацией работы митохондрий при сахарном диабете, предполагая, что это важный подход для борьбы с последствиями этой патологии.Снизив количество или активность транспортеров VDAC1 в мембране митохондрий, действительно можно добиться улучшения состояния клеток при гипергликемии. Потенциально наши результаты могут лечь в основу создания новых лекарственных препаратов для терапии диабета»,— рассказывает руководитель проекта, поддержанного грантом РНФ, Константин Белослудцев, доктор биологических наук, проректор по инновационной деятельности Марийского государственного университета.

Рисунок 4. Наталья Белослудцева за работой на конфокальном микроскопе. Источник: Константин Белослудцев
В дальнейшем авторы планируют протестировать другие способы блокировки белков VDAC1, чтобы понять, какой подход позволит наиболее эффективно бороться с последствиями гипергликемии.
В исследовании также принимали участие ученые из Института общей физики имени А. М. Прохорова РАН (Москва), Института теоретической и экспериментальной биофизики РАН (Пущино), Института биофизики клетки РАН (Пущино) и Московского государственного университета имени М. В. Ломоносова (Москва).
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.