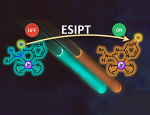
Российские ученые получили стабильный и яркий флуоресцентный белок moxSAASoti, способный менять окраску и интенсивность собственного свечения. Для этого авторы точечно изменили последовательность кодирующего его гена. Ранее все белки, способные «переключать» цвет, были очень чувствительны к окислению и переставали светиться, тогда как новый вариант молекулы не теряет своих свойств. Результаты исследования, поддержанного грантом Российского научного фонда, опубликованы в журнале Scientific Reports.
Флуоресцентные белки при облучении светом определенных длин волн сами начинают светиться. На сегодняшний день существует множество флуоресцентных белков, различающихся по цвету и интенсивности излучения, а также по вариантам изменения окраски. Некоторые из них могут переставать светиться, другие — меняют цвет излучения. Многие флуоресцентные белки способны изменять цвет свечения только один раз. В этом случае структура вещества полностью нарушается и не восстанавливается самостоятельно. Однако белок SAASoti способен многократно изменять интенсивность своего свечения и переходить из зеленой формы в красную. Но SAASoti очень чувствителен к окислителям, которые нарушают его структуру. Это связано с высокой фотохимической активностью входящих в его состав аминокислотных остатков цистеина.
Ученые из Института биохимии имени А. Н. Баха ФИЦ биотехнологии РАН и Московского государственного университета имени М. В. Ломоносова внесли мутации в ген, кодирующий SAASoti, чтобы создать вариант этого белка с минимальным содержанием цистеина. Для этого авторы получили ДНК с нужными заменами и ввели ее в клетки кишечной палочки E. сoli. Таким образом микроорганизмы получили ген, кодирующий белок SAASoti, и синтезировали на его основе белки, отличающиеся от исходных по строению.
Оказалось, что белки совсем без цистеина остались чувствительными к окислителям, как и исходные варианты. Каждая из вводимых мутаций приводила к изменению свойств белка. Так, например, одиночные точечные мутации вызвали его обесцвечивание, а в результате двухточечного мутагенеза был получен ряд белков с различной степенью яркости окраски. При этом исследователи с помощью математического моделирования могли предварительно предсказать влияние конкретной мутации на свойства белка.
Ученые выяснили, что самые благоприятные положения для мутаций — 105 и 117 аминокислота. Соответствующие белки авторы очистили и сравнили между собой по интенсивности окраски, скорости ее изменения, устойчивости к факторам окружающей среды и по другим физико-химическим свойствам. Так, при длине света 520 нанометров наиболее ярким оказался вариант, содержащий в 117 положении аминокислоту треонин — белок moxSAASoti-T. Кроме того, он менял цвет в восемь раз быстрее, чем другие варианты.
«Полученный нами флуоресцентный белок moxSAASoti-T имеет уникальные нехарактерные для других белков свойства, такие как высокая устойчивость к окислителям, быстрое и обратимое изменение интенсивности свечения и окраски. Он может быть использован в современной микроскопии, например в области нейробиологии, для изучения поведения белков в различных условиях среды. Бифотохромные свойства, то есть способность изменять цвет свечения, делают moxSAASoti-T интересным объектом для дальнейших исследований», — рассказывает руководитель проекта Александр Савицкий.
Автор пресс-релиза: Мария Ликанэ
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.