Исследователи из Сколковского института науки и технологий совместно с российскими и американскими коллегами обнаружили связь между двумя компонентами системы бактериальной защиты CRISPR-Cas: один из них уничтожает генетически чужеродные элементы, а другой сохраняет их «в памяти» бактерии. Связь между ними позволяет бактериям эффективно обновлять свою иммунную память в случае заражения мутантными вариантами вируса, которые научились обходить защиту CRISPR-Cas. Статья опубликована в Proceedings of the National Academy of Sciences.
CRISPR-Cas — система адаптивного иммунитета бактерий. Ее белки разрушают ДНК ранее встречавшихся вирусов, сравнивая их со спейсерами — короткими фрагментами, которые хранятся в определенной части бактериального генома. Во время инфекции система CRISPR-Cas добавляет дополнительные спейсеры, взятые из новых вирусов, и таким образом учится распознавать их в будущем. Приобретение спейсеров и их использование для защиты называются адаптацией и интерференцией соответственно.
«Чтобы “обмануть” CRISPR-Cas систему и избежать ее защитного действия, фаги быстро приобретают мутации, которые нарушают соответствие участков их геномов и спейсеров. Поэтому для поддержания эффективной защиты система CRISPR-Cas должна постоянно обновлять набор спейсеров и делать это быстрее, чем возникают новые, мутантные варианты фагов. Системы CRISPR-Cas выработали специальный механизм “праймированной адаптации”, в процессе которой существующие спейсеры, способные распознать мишень (хотя и не всегда точно), стимулируют активное формирование дополнительных спейсеров из той же молекулы ДНК, на которой находится мишень», — рассказывает первый автор статьи, , научный сотрудник Сколтеха Ольга Мушарова.
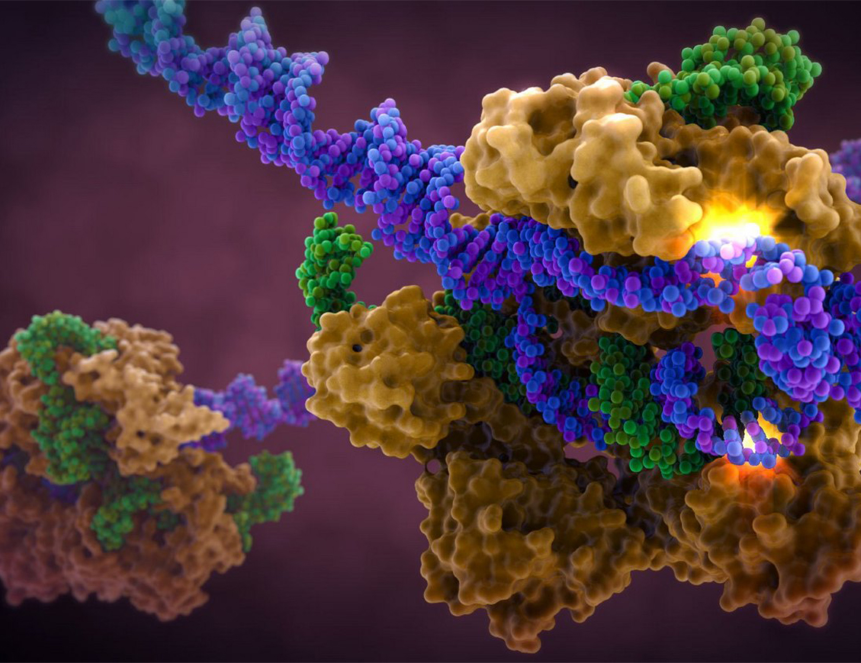
Молекулярный механизм праймированной адаптации пока изучен не до конца, но понятно, что он требует тесной координации между частями механизма, отвечающими за уничтожение чужеродных элементов и за сохранение их фрагментов в памяти. Теперь ученые смогли подтвердить существование «праймингового комплекса», включающего в себя как белки Cas1-Cas2, отвечающие за приобретение новых спейсеров, так и белок Cas3, который расщепляет вражескую ДНК после ее узнавания существующими спейсерами.
В экспериментах ученые показали, что расщепляемые белками Cas3 фрагменты чужеродной ДНК передаются напрямую белкам Cas1-Cas2 в качестве «пре-спейсеров», заготовок для будущих спейсеров. Результаты работы имеют принципиальное значение, поскольку авторы показали наличие связи, координации между процессами интерференции и адаптации. Кроме того, исследование показывает, как можно повысить эффективность CRISPR-адаптации, что важно для различных применений в синтетической биологии, например при использовании бактерий для хранения информации.
Теперь ученые планируют продолжить исследование праймированной адаптации в бактериальных клетках и поиски наиболее эффективных методов создания «устройств памяти» в виде спейсеров в бактериальных ДНК.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.