Группа ученых из Пущино исследовала структуру амилоидных агрегатов мышечного миозин-связывающего белка С. Полученные результаты расширяют представления о молекулярных механизмах образования амилоидов и могут быть полезны для разработки методов лечения амилоидозов. Статья опубликована в International Journal of Molecular Science.
«Задачей нашей работы было углубиться в проблему структурных изменений при формировании амилоидных агрегатов на примере модельного белка — миозин-связывающего белка С. Этот белок в сократительной единице мышц — саркомере — взаимодействует с другими саркомерными белками и образует комплекс, выполняющий структурную функцию и являющийся, по сути, мышечным каркасом», — рассказывает соавтор исследования Александр Бобылев.
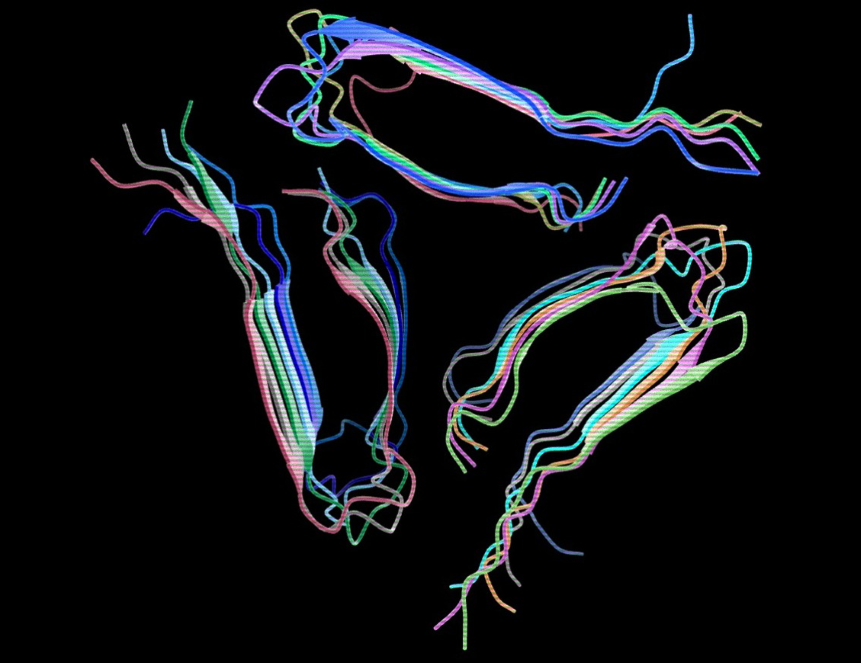
Формирование пространственной структуры белков имеет огромное значение для нормальной жизнедеятельности клеток организма. Неправильное сворачивание белков может приводить к их дальнейшей агрегации, в том числе к появлению амилоидных агрегатов и развитию заболеваний — амилоидозов — болезней Альцгеймера и Паркинсона, диабета II типа, прионных заболеваний. Белки, образующие амилоидные агрегаты, различны по своим характеристикам, но их амилоидные фибриллы имеют общие свойства. Изучение амилоидных агрегатов необходимо для множества сложных биофизических методов анализа. Кроме, того до сих пор не понятно, почему одни амилоидные агрегаты токсичны для организма, а другие, наоборот, не наносят ущерба и могут быть даже полезны (функциональные амилоиды).
Ученые показали, что С-белок в искусственных условиях образует амилоиды даже легче, чем патологические амилоиды. При этом амилоидные агрегаты С-белка в организме не обнаружены. Функциональные амилоиды также не образуют патологических агрегатов в организме, а процесс их амилоидной агрегации обратимый, в отличие от патологических амилоидных агрегатов. Разница между амилоидной агрегацией патологических и функциональных амилоидов кроется, скорее всего, на структурном уровне и сложно уловима.
Агрегаты С-белка in vitro имеют различную морфологию, а также четвертичную кросс-β структуру, что позволяет отнести их к амилоидным. При агрегации С-белка не изменяется вторичная структура, что нехарактерно для большинства патологических амилоидов, что свидетельствует о природой стабильности этого белка. Для формирования амилоидных агрегатов С-белка требуется мало энергии, кроме того, дополнительную стабильность белка обеспечивает низкая идентичность в аминокислотной последовательности между соседними доменами.
Таким образом, эти свойства С-белка могут быть инструментом для формирования в клетках функциональных амилоидных агрегатов. Несомненно, что для борьбы с патологическими амилоидными агрегатами необходимо направлять усилия на исследование причин изменений вторичной структуры, приводящих к накоплению вредных амилоидных отложений.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





